
摘要:
胰腺癌是一种恶性程度极高、预后极差的消化系统肿瘤,在过去的40年中其临床疗效一直无所突破。目前,手术切除是唯一可能治愈胰腺癌的方式,但这种方式通常只有20%病患适用,因此患者能否接受手术治疗又是一个难题。
由于缺乏可应用于下游分析的生物标志物,胰腺癌的治疗一直无所进展。CTC(循环肿瘤细胞)虽然是一个极佳的生物标志物,但是在血液中数量极其稀少,导致捕获率低,从而无法体外扩增,应用于下游的进一步研究,如靶点发现、疗效监控及癌症侵袭性评估等。
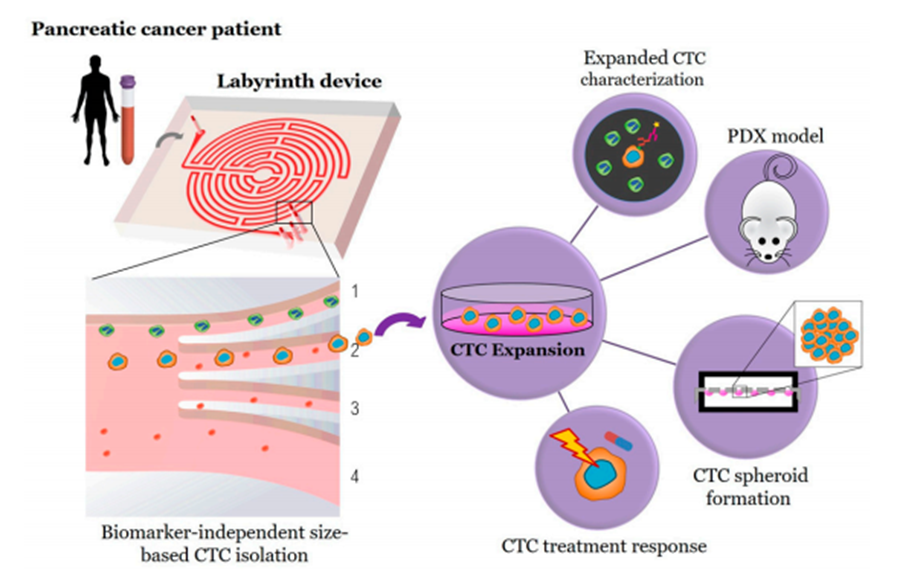
本篇是全世界唯一关于胰腺癌体外扩增成功的报告。我们通过使用高通量、无需使用抗体或特殊试剂、基于大小的物理特性Labyrinth® Chip,从10位局部晚期胰腺癌病患外周血中富集CTC细胞,均获得成功,其中3位病患成功体外扩增。这些扩增的细胞株不仅与实体瘤分子结构及细胞功能相匹配,而且成功移植在PDX模型上。上述研究成功证明CTC体外培养是可行的,更为胰腺癌研究提供宝贵资源,如癌症如何转移及耐药性的产生等。
另外,胰腺癌患者在接受化疗后, CTC数量虽然下降,却具有更高的EMT类细胞比例,表明胰腺癌的侵略性。
讨论:
尽管胰腺癌的临床前和临床研究已经进行数十年,但晚期胰腺癌生存率并没有显著改善,主要因为缺乏用于评估侵袭性、发病机制及用药后疗效的生物标记物,导致新型疗法的研发一直止步不前。鉴于穿刺活检的入侵性及相关风险,在胰腺癌病患中连续使用以评估治疗效果是不切实际的,但外周血中的CTC却可以克服这个困境。通过抽血的方式可随时随地获得CTC来应用于下游研究,却又避免穿刺活检带来对应的风险。
CTC除了可以计数外,还可以用于体外扩增。这些扩增的细胞株不仅可用于功能性研究、拓宽肿瘤生物层面的认知(如侵袭或转移),还可用于用药指导。此外,通过研究细胞株亚型,可设计针对多种不同亚型分类的个性化治疗方案,为彻底治愈胰腺癌开辟新的路径。至今为止,在其他文献中虽然有报道过CTC体外扩增成功的研究(如乳腺癌、结肠癌和肺癌等),却还没有发现胰腺癌的成功案例。本研究共有10位局部晚期胰腺癌病患入组,通过使用Labyrinth® Chip,均富集CTC成功,并且其中3位病患的CTC成功体外扩增。本次捕获的CTC大部分用于体外扩增,小部分用于评估及判断CTC亚型分类如上皮细胞阴性及EMT(上皮间质转化)类。
在上述扩增成功的细胞株中,均发现上皮细胞阴性及大量的EMT类的细胞,表明胰腺癌具有侵略性,还发现与实体瘤相匹配的KRAS G12/G13基因突变。除此之外,无论是2D或者3D培养,每一个细胞株都有一个不同的主导表现型,并且在传代多次后,会导致某个细胞占比过多。因此为了让研究更具有代表性,我们限制最多只能扩增传代10次,但是必须注意的是这些细胞株都均可传代10次以上。通过扩增,观察到这些细胞株表现出多种显著的表现型差异,如从上表皮类到EMT类细胞,并且每个细胞株的增殖速度也不同。另外,我们无法从细胞株的表现型预测其分子型。例如,2号患者的细胞株表型在2D表现为纺锤状(spindle like morphology),3D表型为松散球状(loosely packed spheroids),但其Vimentin表达却比其他病患的细胞株少了很多。这表明仅通过检测CTC基因突变是不够的,更突出多组学研究的重要性。
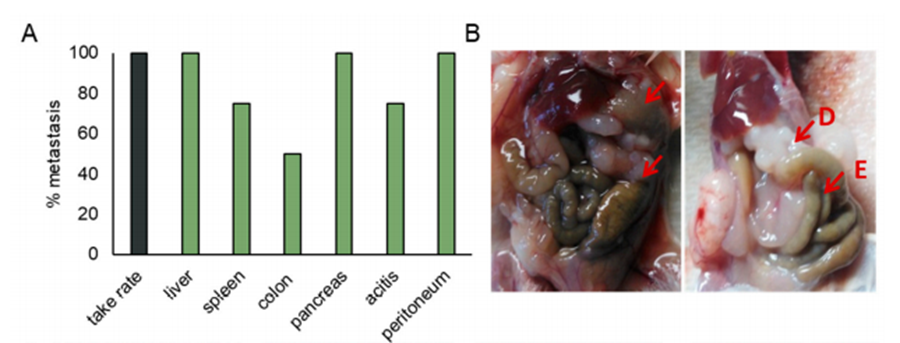
本次研究是首次向全世界展示胰腺癌体外扩增,这次的成功主要归因于使用Labyrinth® Chip大量捕获CTC。通过建立PDX模型,细胞株在小鼠体内展现出与病患常见的转移部位,如肝、肠及腹水症状。这个结果进一步阐明通过使用体外扩增可理解胰腺癌转移。
因为缺乏疗效的反馈指标,目前胰腺癌患者的治疗方法十分有限,通常会根据肿瘤进行分期治疗。通过使用Labyrinth® Chip捕获CTC并体外扩增,并进行药敏测试,可成功填补这个空白。目前最常见2种药敏测试方法是MTT测试细胞毒性及流式细胞仪分析DNA损伤及细胞周期。
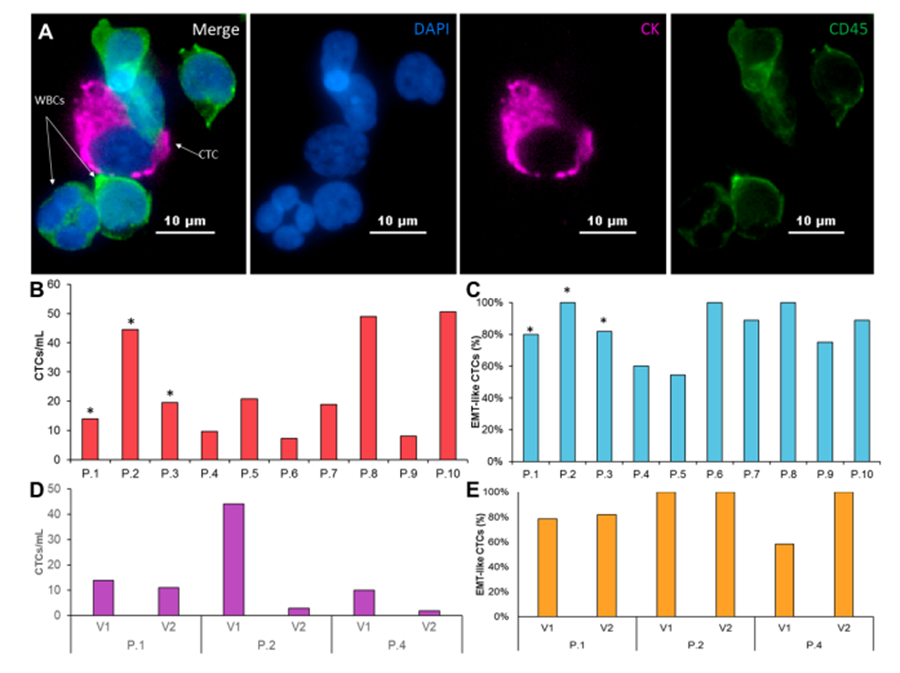
在对比三位患者的化疗前和化疗后的CTC,观察到EMT类CTC在接受吉西他滨(gemcitabine)化疗后占比大幅增多。CTC不仅可以追踪数量变化量,还可用以评估化疗对于胰腺癌病患CTC表现型的影响。目前我们正在规划及实施大规模的胰腺癌临床研究,以收集更多病患在不同治疗周期的样本。这项研究将持续追踪CTC表现型对于不同治疗阶段的反馈,从而可了解药物应答及病患结果的相关性。本次研究一旦完成,将会进一步阐明胰腺癌转移机制及治疗对于CTC显现型及基因型的影响。
结论:
在本次实验中,我们证明使用Labyrinth® Chip可捕获胰腺癌病患的CTC并可用于体外扩增。在10名入组胰腺癌病患中,我们观察到每位病患CTC浓度、EMT类细胞和上皮类细胞之间比例差异很大。在对比其中3名病患化疗前和化疗后CTC数量,在治疗后病患的CTC虽然有所减少,却有更高比例EMT类细胞。这些EMT类细胞体现出胰腺癌的侵袭性。
通过使用对比捕获的CTC与用其扩增的细胞株,两者分子结构及上皮型和间质型细胞比例并无明显差别,因此细胞株可用于判断患者疾病特征,如细胞表现型,基因突变位点及治疗效果。此外,细胞株还可以用于用药指导,在使用吉西他滨和5FU进行药敏测试后,发现不同的药效反馈。
本次研究通过体外扩增胰腺癌CTC实现对其进行药敏测试以及病患的疗效监控,但更长远的意义还在于为彻底治愈胰腺癌打开了新的路径。
