鉴于晚期诊断通常增加癌症死亡率,因此早期检测技术的发展对于减少与癌症相关的死亡和改善患者预后至关重要。越来越多的证据表明,在侵袭性癌症患者中,转移是早期事件,甚至在原发病灶临床可检测之前就已经发生。转移一般是通过血液循环传播到远处非恶性组织的癌细胞形成的,称为循环肿瘤细胞(CTCs)。CTCs在早期癌症患者中被检测到,并且与转移关联,表明可能存在侵袭性疾病,这为患者提供了一种加快诊断和启动治疗的方法,同时可避免对那些生长缓慢、温和的肿瘤的过度诊断和治疗。CTCs作为早期诊断工具已经得到大量的研究,但其检测效率仍需进一步提高。
最近,伦敦玛丽女王大学巴茨癌症研究所和德国汉堡的汉堡大学医学中心研究人员在2023年6月发表在Nature reviews clinical oncology上的名为“Circulating tumour cells for early detection of clinically relevant cancer”的综述中,系统地阐述了研究癌细胞早期血行转移的临床意义,CTCs在早期检测临床相关癌症的潜力,并进一步探讨了可能改善CTC捕获和诊断性能的技术进展。

早期癌症检测和诊断对于改善患者预后至关重要。世界范围内已经启动了许多以癌症早期检测为重点的战略计划,包括欧盟委员会的欧洲战胜癌症计划(Europe’s Beating Cancer Plan)、英国研究与创新加速疾病检测挑战(UK Research and Innovation Accelerating detection of disease challenge)以及美国国立卫生研究院/国家癌症研究所的癌症登月计划(Cancer Moonshot)。
转移是造成癌症相关死亡的主要原因,其一般发生在侵袭性癌症患者肿瘤发展的早期阶段。转移扩散的第一步是癌细胞侵入血液循环,并通过血液循环扩散到身体的其他部位。血液中的CTCs可能是癌症转移早期阶段的首要检测指标,可以通过微创方式监测这一过程,并有可能成为早期检测侵袭性癌症的重要工具。此外,并非所有癌症都是致命的,有些癌症会潜伏多年,因此对生长缓慢的癌症来说可能会导致过度诊断和过度治疗。要使液体活检成为早期癌症诊断的有效工具,就必须将重点放在识别需要立即治疗的侵袭性癌症上。
1、癌症转移
肿瘤细胞从原发灶迁移到机体其他部位的过程,此过程中会发生并积累一系列癌症病理特征相关的基因变异。这些特征支持着这些细胞在其起源组织之外迁移、侵袭、存活和最终生长。转移级联过程始于原发肿瘤细胞对其周围微环境的局部侵袭,随后通过内皮屏障进行迁移,进入血液或淋巴系统。进入循环系统后,CTCs会随血液流向身体的其他部位,然后渗出血管,进行增殖并建立转移病灶(图1)。
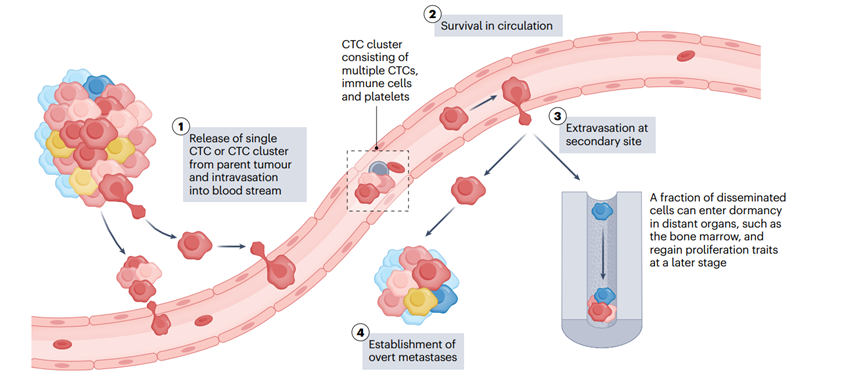
从原发肿瘤向循环系统传播的癌细胞①可以是单个细胞或包含多个循环肿瘤细胞的细胞团簇(CTCs),同时还可能存在免疫细胞和血小板,被称为微栓塞。能够在循环系统中存活的CTCs②可以脱离血液循环③并建立转移性肿瘤④,或者可以进入休眠状态并寄居在远离原发器官的部位,如骨髓。休眠的转移癌细胞可以在以后的阶段重新获得增殖能力,并在数月甚至数年的潜伏期后建立明显的转移病灶,具体取决于原发肿瘤类型。
2、循环肿瘤细胞
CTCs是从实体肿瘤中脱落并进入循环系统的癌细胞,能够在不同的部位渗出并建立明显的转移病灶。基于抗上皮细胞粘附分子(EpCAM)抗体的CTC捕获技术在CTCs作为生物标志物的初期临床应用中发挥了重要作用,其中的CELLSEARCH平台是首个获得FDA批准用于临床应用的CTC检测技术。然而,在分离CTCs时需要考虑EMT现象,因为在这个转变过程中,EpCAM的表达通常会降低。因此,不依赖抗原表位的分离策略可能更有效地分离所有亚型的CTCs。例如,基于细胞大小的Parsortix分离系统已在前列腺癌的患者中识别出具有上皮和间充质特征的CTCs(图2)。
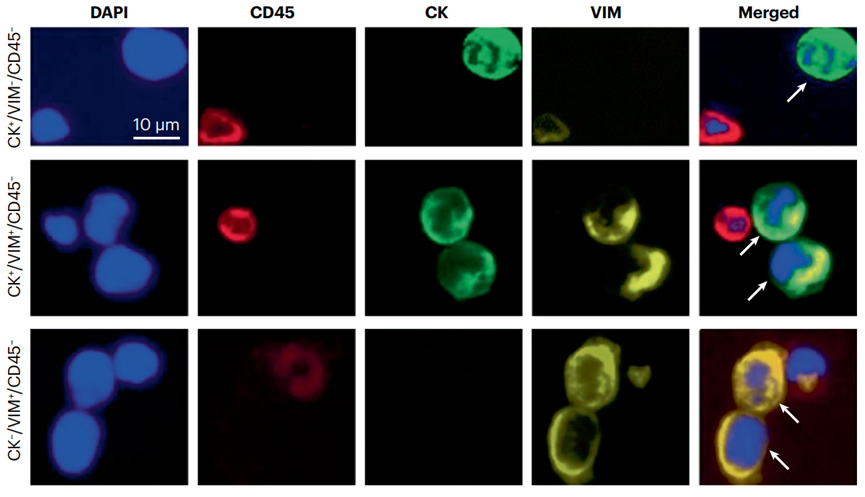
免疫荧光显微镜图像展示了使用基于细胞大小的Parsortix分离系统从患有前列腺癌的患者中分离出的具有特征标记物表达差异的三种循环肿瘤细胞(CTCs)亚群。第一行:典型的上皮型CTC,它对上皮标记物细胞角蛋白(CK)呈阳性,对间充质标记物波形蛋白(VIM)和白细胞标记物CD45呈阴性。第二行:两个CTCs正在经历上皮间质转化,其CK和VIM染色都呈阳性。第三行:典型的间质型CTCs,其VIM呈阳性而CK呈阴性。
研究表明,某些亚型的CTCs(例如部分EMT或间充质表型)具有更大的远端种植转移的潜力,并与患者的预后不良相关。此外,不仅CTC数量在睡眠或休息阶段增加,而且这些CTCs与在活跃阶段产生的CTCs相比,具有更高的转移能力。CTC团簇在传播远处转移病灶方面可能起着重要作用。这些CTC团簇是由两个或更多CTC组成的群体,可以只包含CTC(同种型),也可以包括各种基质细胞,如与癌症相关的成纤维细胞,以及血小板和免疫细胞(异种型)。与单个CTC相比,CTC团簇具有更强的转移能力。CTCs表征分析包括遗传学和表观遗传学以及蛋白质水平,这些特征可以帮助我们了解形成转移病灶的许多过程(图3)。
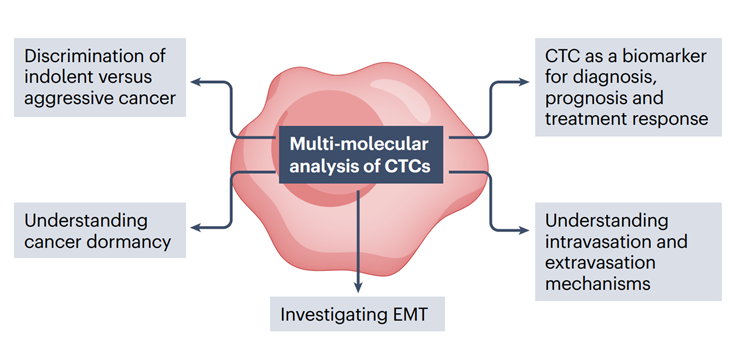
对循环肿瘤细胞(CTCs)进行多分子分析可以提供丰富的信息,涉及癌症扩散和转移的各个过程,包括癌细胞的血管内进入、渗出、休眠和上皮间质转化(EMT)。此外,成功检测到以CTCs形式存在的癌细胞扩散可以提供更多侵入性癌症诊断和预后的生物标志物。
3、循环肿瘤细胞在癌症的早期检测中的作用
多种癌种的CTC检测与临床上具有重要意义的癌症密切相关。CTCs具有在临床相关癌症的早期检测/诊断的潜力,仍需要进一步的研究和技术改进。目前,许多临床试验正在研究CTCs在早期癌症诊断中的应用,包括PROLIPSY用于前列腺癌(NCT04556916)、乳腺癌(NCT03511859)、非小细胞肺癌(NCT02380196)、结直肠癌(NCT05127096)和胰腺癌(PANCAID)的试验(表1)。如果这些临床试验取得积极的结果,CTCs在早期癌症检测中的应用可能成为现实。
4、循环肿瘤细胞检测未来的发展方向
大量文献表明CTC作为一种可能的生物标志物,在恶性肿瘤的各个方面(从诊断到监测治疗反应)都有应用,但仍需要更多的研究来将CTC发展为可靠的早期癌症检测生物标志物。尽管仍面临一些挑战,新发表实验数据强调了CTC液体活检在早期癌症检测中的潜力。由于CTC与转移病灶的密切关联,因此CTC在特定地侵袭性癌和在疾病仍可治愈的早期进行治疗干预方面具有显著优势。这种优势还可以帮助避免过度诊断某些慢性癌症(前列腺、乳腺、肺和甲状腺癌等)。在这里,我们分享了对未来发展方向的思考,以加速CTC在早期癌症检测中的应用。
未来发展方向包括:
- 优化不依赖于抗原表位的CTC分离方法。
- 改变采血部位以增加CTC数量,例如对于某些癌症的高风险个体,使用肿瘤引流静脉进行采血。
- 改变采血方式,使用血液分离或涂覆抗体的可插入血管装置等方法,从通过静脉流过的血液中收集CTC。
- 优化采血时间(可能通过在夜间或休息期间采样),以确保最大程度地捕获CTC。
- 开发体内成像方法,使用可注射的CTC探针和可穿戴式检测设备。
- 进一步分子特征化CTC,以更好地识别临床相关的侵袭性癌症,并最小化对无关紧要的慢性肿瘤的过度诊断。
- 研究应用机器学习和人工智能分析大规模数据集,以减少观察者和实验室之间的变异性。
- 开发早期多癌症检测策略,使用CTC而无需特定癌症类型的标志物,随后使用器官特异性肿瘤标志物/靶向成像进行进一步的诊断。
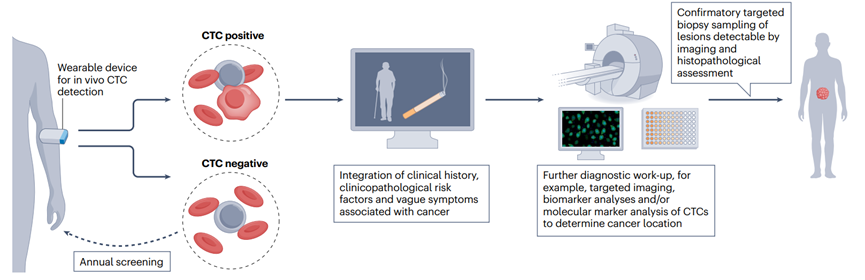
未来可能会开发出可穿戴设备,以非侵入性方式在较大血液样本中测量CTCs,超过目前采样的容量限制。这种设备可能通过注射探针对CTCs进行标记,并直接在血管中成像。将临床和家族史与靶向成像和生物标志物分析相结合,可以确定可检测到CTCs的个体的肿瘤部位,最终进行确诊。如果可穿戴设备没有检测到任何CTCs,个体可能需要定期(例如每年)/在高癌症风险/出现任何相关症状时尽快重复测试。
5、结论
微转移在肿瘤发生的早期阶段就已经形成。越来越多的证据表明,在侵袭性癌症的发展早期就可以检测到CTCs。因此,CTCs在早期癌症检测中具有巨大潜力,可以识别临床相关的肿瘤,同时避免对慢性疾病的过度诊断。当前的挑战在于开发可靠地采集和分析这些稀有但具有重要意义的细胞的技术。随着技术的发展,通过非侵入性或微创性采样,在合适的时间对大量血液进行高灵敏度的CTC检测的技术的成功应用于将改变早期癌症检测的范式,并从根本上改善患者的癌症预后。
