
摘要
近年来,突破性技术的产生让研究者能够对稀有细胞诸如循环肿瘤细胞(CTC)进行识别和研究,同时也孕育了液体活检等许多新兴的临床研究领域。通过对CTC进行研究揭示其不同的生物学表型,如同质型团簇(仅癌细胞)和异质型团簇(癌细胞与免疫或基质细胞相互作用)的形成,对肿瘤治疗提供了新的见解。研究团队进一步综述了CTC检测、捕获和下游分析的现有技术,参考针对CTC的临床试验讨论了临床转化,最后强调了促进转化应用的关键挑战和必要的研究重点。
CTC与癌症转移
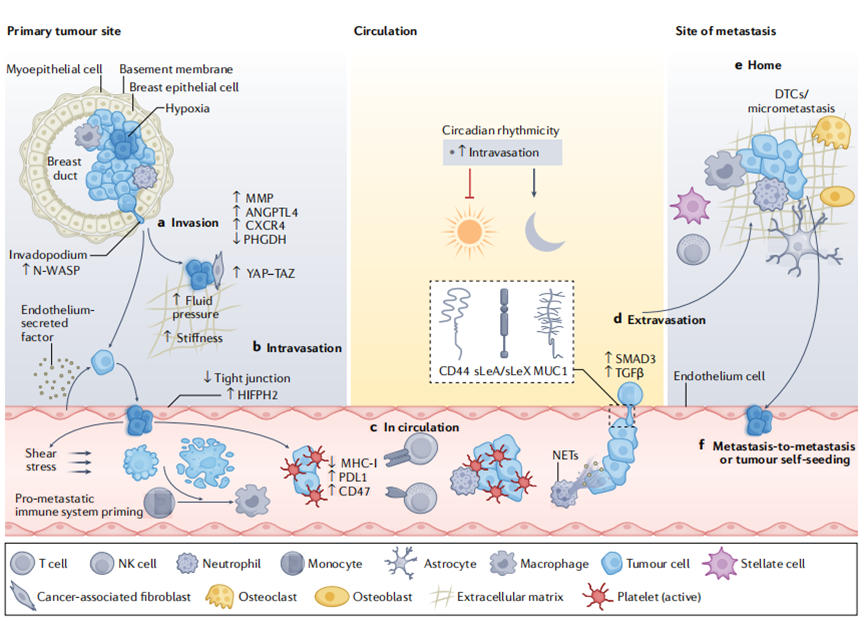
癌症转移主要通过肿瘤细胞对血管或淋巴系统的直接入侵,直接蔓延至临近组织的情况相对少见。至今为止,大量的文献都认为并支持血液传播是癌症最主要的转移路径,而通过血液传播的第一步就是原位灶的肿瘤细胞复制并逃逸进入血液,这些细胞就是循环肿瘤细胞(CTC),当CTC的侵袭达到一定程度时,就可以在远端组织着落并生长,即发生癌症转移。
由于CTC团簇更容易在远端停留生长,因此CTC团簇在血液中的循环时间更短,约为6-10分钟,而单个CTC在血液中的循环时间则为25-30分钟。同时,在血液中循环的时间越短,CTC的存活率越高,因为血液中的高剪切应力会导致细胞变形,同时在血液中CTC也更容易碎裂或死亡。离开血液循环并在新的组织着落的CTC被称为播散性肿瘤细胞(DTC),CTC不同的生物学特性、组织微环境、不同的器官细胞等因素都会影响CTC的停留生长。
CTC的生物学特征
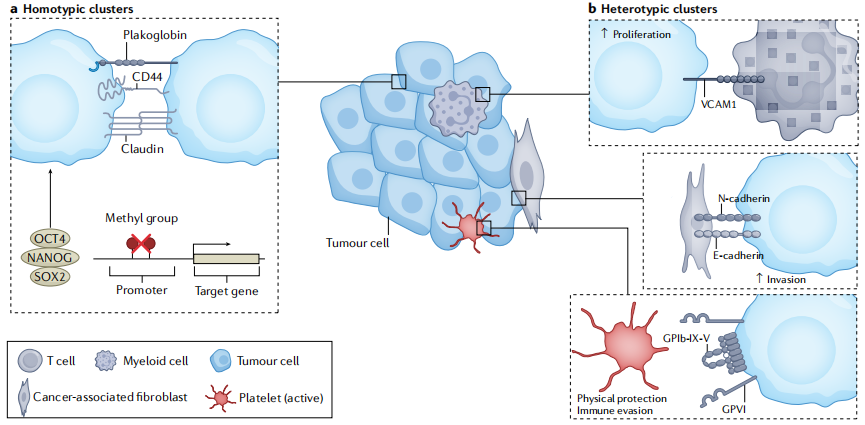
CTC表型异质性和CTC团簇:
CTC的很多生物学特征使其能够更有效地实现转移扩散,例如中间水平的上皮间充质转变、CTC团簇的干样特征等。多项研究表明CTC团簇虽然和单个CTC相比数量较少,但是转移能力却是单个CTC的100倍左右。除了CTC自身形成团簇,CTC还可以和血小板、癌症相关成纤维细胞(CAF)、髓细胞等发生聚集。例如CTC和血小板的相互作用可以提高血管通透性,并为CTC提供保护防止其被T细胞和NK细胞清除。而中性粒细胞则能增加CTC的增殖和转移能力,帮助CTC躲避免疫系统的攻击。
TC的分子异质性:
CTC从肿瘤的不同部位持续脱落,因此能够提供肿瘤异质性的动态信息。借助单细胞技术和生物信息工具,现在已经能够实现对单个CTC的分析研究。研究发现,同一个病人的原位灶和转移灶的拷贝数变异、治疗靶点和抗性突变仅有部分相同。来自不同原位灶的CTC会带有“预设”的器官异质性,而从不同血管位置捕获的CTC也会展现出独特的分子特性。总结来说,CTC的表型和分子异质性促进了肿瘤转移的适应过程。
CTC的释放时间:
除了上文提到的异质性,CTC的传播动力学也是影响肿瘤细胞扩散的一个关键因素。现有的CTC检测应用都假设外周血中的CTC数量在全天没有明显的变化,但是这可能导致结果不统一,限制临床应用。但是利用体内荧光流式细胞术对人类前列腺癌的原位小鼠模型进行检测得到的结果却表明,CTC会受到昼夜节律的影响,本文作者的实验室最近也验证了CTC扩散的动力学,乳腺癌患者和其建立的小鼠模型都表明CTC数量随着昼夜节律变化明显,受到荷尔蒙(例如褪黑素)的影响,睡眠期间CTC的数量最多。这些发现说明现有的液体活检标准可能需要被重新评估,同时也需要创新性的、控制时间变量的临床试验来探索其转化价值。
CTC的检测和分析
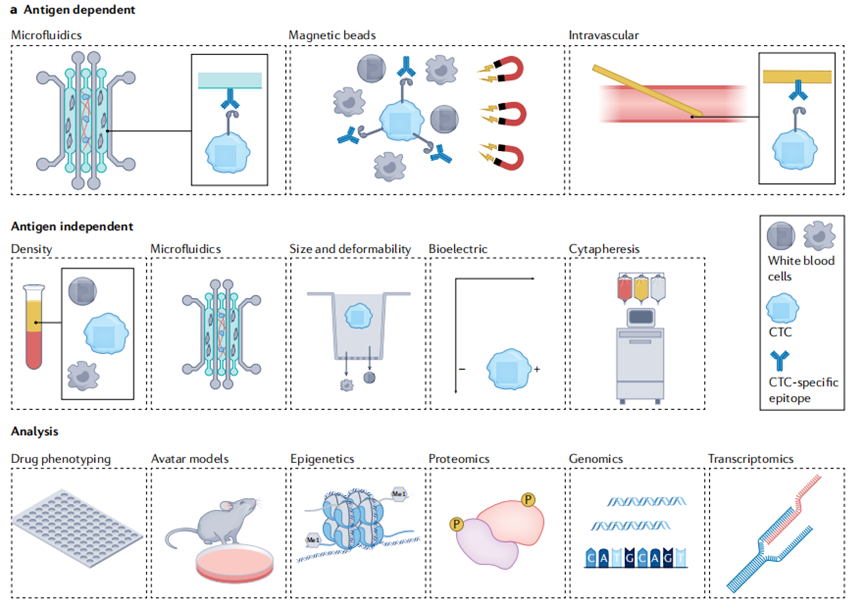
CTC具有高转移倾向,是一种独特的液体活检分析物,同时和传统的组织活检切片相比也被认为能够揭示更多的癌症相关信息。由于CTC检测只需要抽取少量血液进行,因此能够长期、多次检测来评估临床预后效果,或用于肿瘤早筛或复发监测,这使CTC成为实时临床应用和个性化药物的理想生物标志物来源。但是由于CTC数量稀少,因此如何有效富集CTC仍然是下游分析应用的主要挑战。
现有的CTC富集方式可以大致分为两类:抗原依赖型和非抗原依赖型。抗原依赖型主要利用CTC表达而其他细胞表达水平很低的抗原来实现阳性富集,例如FDA批准的CellSearch系统和AdnaTest CTC Select都使用了基于EpCAM表达的免疫磁珠法。其他的标记例如pan-CK和CD45则分别用于提高灵敏度和特异性。抗原非依赖型方式主要利用CTC的大小、电荷、密度或弹性等物理特性进行CTC的富集,同时也在开发多模态方法以进一步提升灵敏度和特异性,例如将流体控制和免疫磁珠结合,或者将离心、免疫组织化学和荧光原位杂交结合起来。
总体而言,尽管CTC的捕获和下游分析看上去非常可行,实际上相关技术还远没有在临床上常规应用。如果想要成为一项稳定的临床应用,CTC技术仍有许多待被解决的问题,例如由于细胞大小和弹性差异带来的细胞损失、CTC纯度低、设备堵塞、所需时间长、自动化困难等。
基于CTC的临床应用
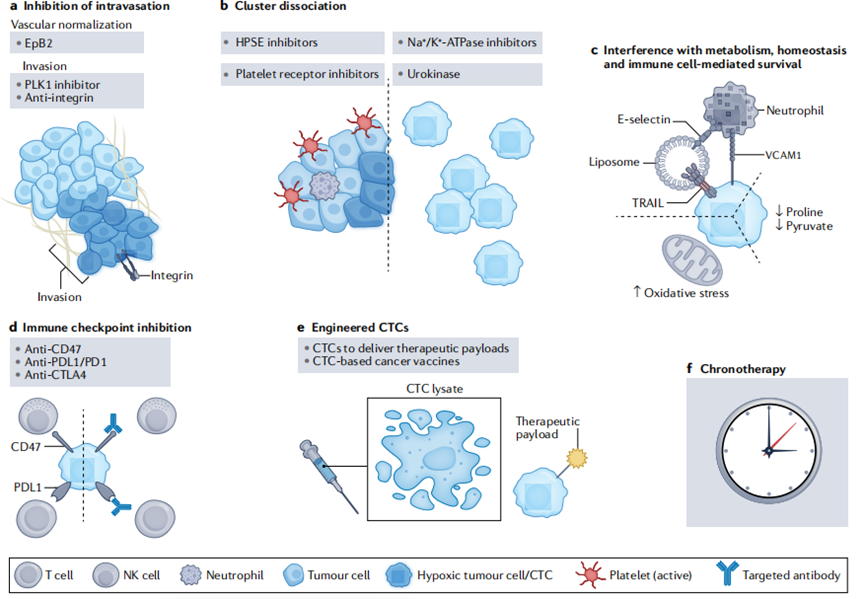
CTC的脆弱性和靶向CTC:
消除肿瘤转移的现有策略和针对原位灶的方法基本相同,这些方法都没有针对转移过程本身。鉴于CTC的特性,靶向CTC理论上可以直接打断转移进程。靶向CTC的潜在方法有很多,例如通过使缺氧的肿瘤微环境正常化来抑制癌细胞向血管内的渗透,利用HPSE抑制或抑制CTC上的血小板受体来解离CTC团簇或避免CTC团簇的形成,通过提高氧化应激和抑制丙酮酸或脯氨酸的代谢过程等代谢干扰来抑制CTC存活率,利用免疫检查点抑制剂来增强免疫系统对CTC的清除,使用改造过的CTC作为治疗载体或利用CTC进行肿瘤疫苗开发,根据CTC释放的节律性开发基于CTC的时间疗法等。
CTC的预后和预测价值:
在临床试验中,所有主要癌种的外周血中都已检测到CTC,且CTC的预后价值已在乳腺癌、前列腺癌、结直肠癌和小细胞/非小细胞肺癌中得到验证。在初发的转移性乳腺癌、前列腺癌和结直肠癌患者中,治疗前CTC数量越多预示着越短的无病和总生存期。更重要的是多个研究表明治疗后的CTC数量变化和基线CTC数量相比具有更好的疗效预测效果,如果治疗后CTC持续存在则表明预后效果不佳。除了单个CTC的计数,CTC团簇丰度的评估会明显提高病人治疗的预后价值,但是依赖抗原的CTC技术在计数时将会面临假阴性的风险。
CTC在疾病临床表现前7-9周就已经能被检测到,说明CTC分析可以帮助病人预测肿瘤残留和复发风险,同时也能用于癌症早筛。
CTC已被写入第五版WHO肿瘤分类:乳腺癌和第七版AJCC癌症分期管理,其真正的价值在于高转移性肿瘤亚克隆的代表性和作为分子和功能研究最新生物标志物来源的丰富性。CTC作为活细胞可以用于体外细胞培养和药敏试验,且有辅助治疗决策的潜力。
总结
肿瘤转移仍是提升治疗效果的一大难题,因为它是造成癌症相关死亡的最主要原因。CTC团簇早期和最近发现的生物特性突出了其复杂性,同时也暴露了CTC的脆弱性,为靶向治疗提供了机会。然而为了理解CTC的所有潜能,现有的CTC计数和预测方式还不够,需要进一步发展精准控制的分子分型和更为精确的用于预测的生物标志物。技术和创新的进步将会不断优化CTC的表征手段,克服现有诊断和治疗方法的局限性。
科学界现在也正在努力将针对肿瘤转移的治疗发展为主要的治疗方向,将转移生物学和CTC的有效捕获方式应用在临床试验设计和转化将会加快这一发展。我们设想未来CTC可能会通过及时识别侵袭性肿瘤亚克隆而在住院分层和治疗决策中发挥关键作用,而最终靶向CTC可能将会预防转移并提高存活率。
